Zelltherapeutika der nächsten Generation
Mit unserer Arbeit leisten wir Pionierarbeit bei der Entwicklung und Umsetzung von Zelltherapeutika der nächsten Generation zur Heilung von Kinderkrebs. Unsere Forschung ist darauf ausgerichtet, die Erstellung von Immunzell- und Tumorprofilen voranzutreiben, Immunmodulationsstrategien zu optimieren und CAR/TCR-T-Zelltherapien zu entwickeln, um die Wirksamkeit gegen solide Tumore zu verbessern. Um die Grenzen von Zelltherapien bei soliden Tumoren zu überwinden, müssen wir ein tieferes Verständnis der Tumormikroumgebung (TME), ihrer zellulären Zusammensetzung und der Mechanismen zur Umgehung des Immunsystems gewinnen. Wir nutzen modernste räumliche Einzelzell-Omikographie durch Ultra-High-Content-Imaging, um individuelle immunvermeidende Signaturen in primären Patientenproben und Proben aus Mausmodellen zu entschlüsseln.
Dieser Ansatz verbessert unsere Fähigkeit, das Ansprechen auf Therapien vorherzusagen und leitet die Entwicklung von kombinatorischen Therapien und Immunzell-Engineering-Strategien. Parallel dazu arbeiten wir an der Umprogrammierung des TME, um sein volles antitumorales Potenzial freizusetzen und eine Mikroumgebung zu fördern, die die T-Zell-Antworten verstärkt und aufrechterhält. Schließlich stehen wir an der Spitze der Entwicklung von CAR-T- und TCR-T-Zelltherapien der nächsten Generation, die auf solide Tumore zugeschnitten sind, mit dem Ziel, die Wirksamkeit zu verbessern und die Hindernisse für ein dauerhaftes therapeutisches Ansprechen zu überwinden.

Spotlight - AG Seitz
Wir leisten Pionierarbeit bei der Entwicklung von CAR-/TCR-T-Therapien für Krebs im Kindesalter, indem wir die Mikroumgebung des Tumors entschlüsseln und umprogrammieren, wobei wir uns auf modernste räumliche Omics stützen, um dauerhafte Immunreaktionen gegen solide pädiatrische Tumoren zu ermöglichen. Dies gießen wir aktuell in eine umfassende Spotlight-Seite, die hier bald zu finden sein wird.
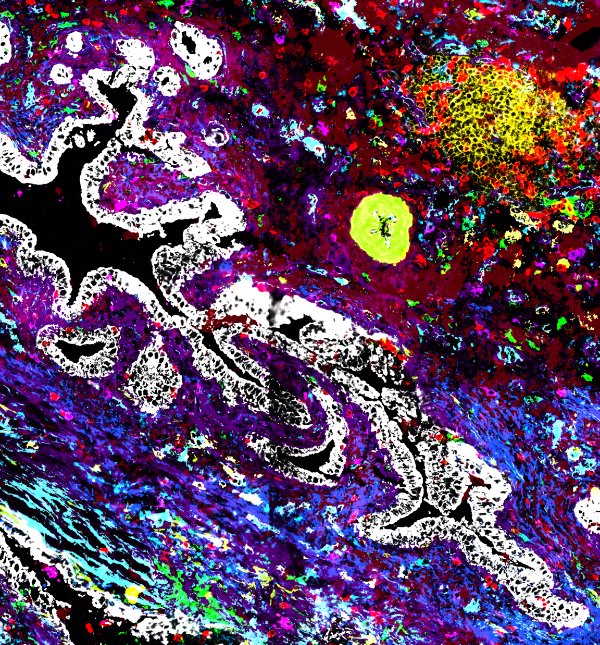
Unsere Immunphänotypisierungs-Pipeline, die MACSima Imaging Cyclic Staining (MICS) verwendet, ermöglicht die hochauflösende Erstellung von Einzelzellprofilen von Immun- und Tumorzellen, um zelluläre Heterogenität, Evasionssignaturen, Funktionszustände und Zell-Zell-Interaktionen aufzudecken. Unser Ziel ist es, die Schlüsselmechanismen zu entschlüsseln, die Immunantworten unter Immuntherapie in der klinischen und präklinischen Umgebung antreiben oder dämpfen, indem wir ultrahochauflösende Bildgebung und hochentwickelte Datenanalyse anwenden. Darüber hinaus konzentrieren wir uns auf die Entdeckung neuartiger Biomarker und therapeutischer Ziele, um letztlich die Präzisionsmedizin voranzutreiben. Im Rahmen von ImmunoINFORM planen wir, die Stratifizierung von Patienten durch die Identifizierung von Therapiezielen und die Stratifizierung des Immunstatus zu unterstützen. Unser umfassender räumlicher Ansatz zielt darauf ab, Therapieentscheidungen und -bewertungen sowohl im klinischen als auch im präklinischen Umfeld zu verbessern, die translationale Wissenschaft mit der klinischen Anwendung zu verbinden und dadurch die Entwicklung gezielter und wirksamer Immuntherapien zu beschleunigen.
Das immunsuppressive TME stellt ein Haupthindernis für wirksame T-Zell-basierte Immuntherapien bei soliden Krebserkrankungen dar und führt zur Erschöpfung der T-Zellen und zum Scheitern der Behandlung. Unsere Gruppe arbeitet mit fortschrittlichen Immunzytokinen, innovativen Fusionsproteinen, die für eine starke und lokalisierte Immunaktivierung im Tumor und seinem TME entwickelt wurden. Diese gezielte Verabreichung zielt darauf ab, immunsuppressive Makrophagen (z. B. M2-Polarisierung) in aktive, antitumorale Zellen umzuprogrammieren und erschöpfte tumorspezifische T-Zellen zu verjüngen und ihre zytotoxische Funktion wiederherzustellen. Durch die Konzentration immunstimulierender Signale direkt am Tumor wollen wir die mit herkömmlichen Zytokintherapien verbundenen systemischen Toxizitäten umgehen und eine robuste, lang anhaltende Immunität gegen Krebs hervorrufen. Unsere Forschung konzentriert sich auf das rationale Design, die rigorose präklinische Bewertung und das mechanistische Verständnis dieser neuartigen Immunzytokine, um den Weg für transformative Behandlungen für ein Spektrum solider maligner Erkrankungen zu ebnen. Wir setzen uns dafür ein, die Herausforderungen des TME zu überwinden und das gesamte therapeutische Potenzial des Immunsystems zur wirksamen Bekämpfung solider Tumore zu erschließen.
Während CAR-T-Zellen in der Klinik zur Behandlung hämatologischer Krebsarten eingesetzt werden, ist die Wirksamkeit der CAR-T-Zelltherapie bei pädiatrischen soliden Tumoren begrenzt. Um die Grenzen der herkömmlichen CAR-T-Technologie zu überwinden, haben wir das Adapter-CAR-T-Zellsystem (AdCAR-T) entwickelt. Durch die Aufteilung von Antigenerkennung und CAR-T-Aktivierung und die Einführung von Adaptermolekülen ermöglicht das System eine präzise quantitative und qualitative Regulierung der CART-Aktivität und verbessert so die Sicherheit und Wirksamkeit (Antigen-Evasion).
Pädiatrische Krebserkrankungen, insbesondere Sarkome, zeichnen sich durch niedrige somatische Mutationsraten und wiederkehrende genomische Veränderungen, wie onkogene Fusionsgene, aus. Diese genetischen Ereignisse stellen ideale therapeutische Ziele dar, sind aber mit herkömmlichen Medikamenten nur schwer zu behandeln. Unsere Forschung konzentriert sich auf den Einsatz gentechnisch veränderter T-Zellen zur Bekämpfung dieser onkogenen Veränderungen. T-Zellen können Neoantigene erkennen, die von Punktmutationen oder Genfusionen herrühren, wenn sie von HLA-Molekülen präsentiert werden, und können so gegen bisher "unheilbare" Krebstreiber vorgehen. Durch T-Zell-Engineering wollen wir gezielte Immuntherapien für pädiatrische Krebserkrankungen entwickeln und so neue Behandlungsstrategien für diese schwierigen Krankheiten bereitstellen.
Atar, D., Ruoff, L., Mast, A. S., Krost, S., Moustafa-Oglou, M., Scheuermann, S., Kristmann, B., Feige, M., Canak, A., Wolsing, K., Schlager, L., Schilbach, K., Zekri, L., Ebinger, M., Nixdorf, D., Subklewe, M., Schulte, J., Lengerke, C., Jeremias, I., Werchau, N., … Seitz, C. M. (2024). Rational combinatorial targeting by adapter CAR-T-cells (AdCAR-T) prevents antigen escape in acute myeloid leukemia. Leukemia, 38(10), 2183–2195. https://doi.org/10.1038/s41375-024-02351-2
Scheuermann, S., Kristmann, B., Engelmann, F., Nuernbergk, A., Scheuermann, D., Koloseus, M., Abed, T., Solass, W., & Seitz, C. M. (2024). Unveiling spatial complexity in solid tumor immune microenvironments through multiplexed imaging. Frontiers in immunology, 15, 1383932. https://doi.org/10.3389/fimmu.2024.1383932
Önder, C. E., Moustafa-Oglou, M., Schröder, S. M., Hartkopf, A. D., Koch, A., & Seitz, C. M. (2024). Precision Immunotherapy Utilizing Adapter CAR-T Cells (AdCAR-T) in Metastatic Breast Cancer Leads to Target Specific Lysis. Cancers, 16(1), 168. https://doi.org/10.3390/cancers16010168
M. Sigle, A.-K. Rohlfing, M. Kenny, S. Scheuermann, N. Sun, U. Graeßner, V. Haug, J. Sudmann, C. M. Seitz, D. Heinzmann, K. Schenke-Layland, P. B. Maguire, A. Walch, J. Marzi, M. P. Gawaz. Nat Commun. 2023; 14: 5799. https://doi.org/10.1038/s41467-023-41417-0
Atar, D., Mast, A. S., Scheuermann, S., Ruoff, L., Seitz, C. M., & Schlegel, P. (2022). Adapter CAR T Cell Therapy for the Treatment of B-Lineage Lymphomas. Biomedicines, 10(10). https://doi.org/10.3390/biomedicines10102420
Seitz, C. M., Mittelstaet, J., Atar, D., Hau, J., Reiter, S., Illi, C., Kieble, V., Engert, F., Drees, B., Bender, G., Krahl, A. C., Knopf, P., Schroeder, S., Paulsen, N., Rokhvarguer, A., Scheuermann, S., Rapp, E., Mast, A. S., Rabsteyn, A., Schleicher, S., … Schlegel, P. (2021). Novel adapter CAR-T cell technology for precisely controllable multiplex cancer targeting. Oncoimmunology, 10(1), 2003532. https://doi.org/10.1080/2162402X.2021.2003532
Seitz, C. M., Flaadt, T., Mezger, M., Lang, A. M., Michaelis, S., Katz, M., Syring, D., Joechner, A., Rabsteyn, A., Siebert, N., Troschke-Meurer, S., Zumpe, M., Lode, H. N., Yang, S. F., Atar, D., Mast, A. S., Scheuermann, S., Heubach, F., Handgretinger, R., . . . Schlegel, P. (2021). Immunomonitoring of Stage IV Relapsed Neuroblastoma Patients Undergoing Haploidentical Hematopoietic Stem Cell Transplantation and Subsequent GD2 (ch14.18/CHO) Antibody Treatment. Front Immunol, 12, 690467. https://doi.org/10.3389/fimmu.2021.690467
Seitz, C. M., Schroeder, S., Knopf, P., Krahl, A. C., Hau, J., Schleicher, S., Martella, M., Quintanilla-Martinez, L., Kneilling, M., Pichler, B., Lang, P., Atar, D., Schilbach, K., Handgretinger, R., & Schlegel, P. (2020). GD2-targeted chimeric antigen receptor T cells prevent metastasis formation by elimination of breast cancer stem-like cells. Oncoimmunology, 9(1), 1683345. https://doi.org/10.1080/2162402X.2019.1683345
- Christian Seitz (Group leader)
- Sophia Scheuermann (PhD Student, Project Coordinator)
- Simon Krost (PhD Student)
- Elisabeth Pezzuto (PhD Student)
- Isa-Maria Klink (PhD Student)
- Katharina Maier (Clinician)
- Fabienne Engelmann (Clinician)
- Anna-Sophia Mast (MD-PhD Student)
- Kathrin Wolsing (TA)