Pädiatrische Gliomforschung
Die Forschungsgruppe “Pädiatrische Gliomforschung”, die der gleichnamigen DKFZ-Abteilung entspricht, wird von David T. W. Jones geleitet und ist Teil des DKFZ-Forschungsschwerpunktes "Funktionelle und strukturelle Genomforschung". Die Forschung der Gruppe konzentriert sich in erster Linie auf pädiatrische Gliome (sowohl niedriggradige (LGG) als auch hochgradige Gliome (HGG)) - den häufigsten pädiatrischen Gehirntumor. Mit Hilfe modernster genomischer, epigenomischer und funktioneller Technologien wird versucht, die Biologie dieser Tumoren noch besser zu verstehen.
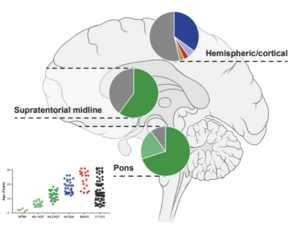
LGG sind in der Regel langsam wachsende Tumoren mit guten Überlebensraten, die jedoch aufgrund der Auswirkungen der Behandlung und der Lage des Tumors oft mit einer erheblichen Beeinträchtigung der Lebensqualität einhergehen. Rezidive sind häufig und stellen eine große Belastung für Patienten und Familien dar.
HGG sind genetisch sehr viel vielfältiger und gehören zu den aggressivsten menschlichen Krebsarten. Die kombinierte Störung mehrerer zellulärer Prozesse führt zu sich schnell teilenden Krebszellen, die das umgebende Hirngewebe diffus infiltrieren, was meist tödlich endet.
Ein weiterer wichtiger Schwerpunkt der Gruppe ist die Koordinierung zweier internationaler molekulardiagnostischer Programme: die INFORM-Studie zur Identifizierung möglicher Zielstrukturen für Medikamente bei pädiatrischen Hochrisikokarzinomen und die MNP Int-R-Studie zur Untersuchung und Validierung der molekularen Analyse als Instrument für eine genaue Klassifizierung von Hirntumoren.

Spotlight - Abt. Jones
Multiomische Neuropathologie zur verbesserten diagnostische Genauigkeit
Ein großes prospektives klinisches Validierungsprogramm hat gezeigt, dass der Einsatz von DNA-Methylierung und Gen-Panel-Sequenzierung zur Ergänzung von Standardtechniken für die pädiatrische Hirntumorpathologie vorteilhaft ist und die diagnostische Genauigkeit erheblich verbessert.
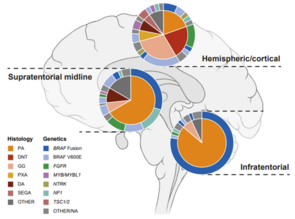
Gliome sind die häufigsten ZNS-Tumoren bei Kindern und Jugendlichen. Die epigenetische Analyse hat sich in der pädiatrischen Hirntumorforschung zu einem immer wichtigeren Analyseinstrument entwickelt, um die Diagnostik zu verbessern und die molekularen Mechanismen zu verstehen, die dem Fortschreiten der Entwicklung zugrunde liegen. DNA-Methylierungssignaturen zusammen mit integrierter Histopathologie sind heute weltweit anerkannte Diagnoseinstrumente und wurden in die neuen Richtlinien der WHO-Klassifikation von ZNS-Tumoren aufgenommen. Wir befassen uns mit epigenetischen Modifikationen wie DNA-Methylierungsmustern und Histonmodifikationen, die die Genexpression verändern können. Durch die Identifizierung spezifischer Muster epigenetischer Veränderungen in pädiatrischen Gliomen wollen wir neue Diagnoseinstrumente und Therapien entwickeln, um die klinische Behandlung von Kindern mit dieser Art von Hirntumoren zu verbessern. Unsere Forschung hat bereits wichtige Erkenntnisse über die Biologie pädiatrischer Gliome erbracht und verspricht die Entwicklung neuer wirksamer Behandlungen in der Zukunft.
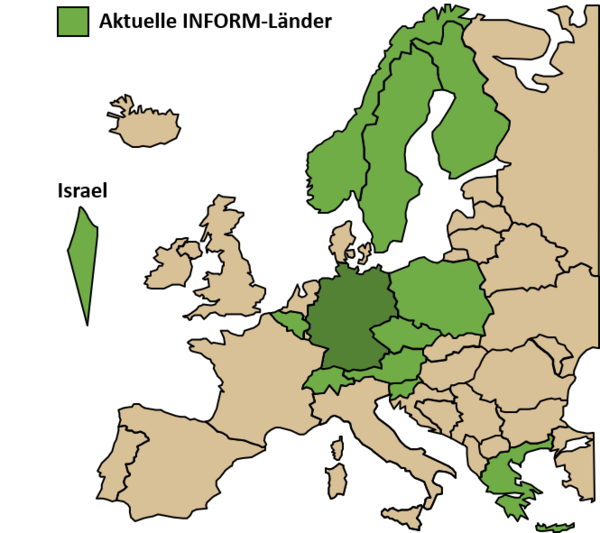
Unsere Abteilung spielt eine Schlüsselrolle bei der Organisation des internationalen Präzisions-Onkologie-Programms INFORM (INdividualized therapy FOr Relapsed Malignancies in children), indem sie die molekularen Analysen und die Interpretation der Patientendaten in Echtzeit koordiniert. Auf diese Weise bieten wir Zugang zu umfassenden molekularen Profilen für pädiatrische Hochrisikopatienten in ganz Europa. Die INFORM-Familie deckt 13 europäische Länder ab, wird in mehr als 100 pädiatrischen Onkologie-Forschungszentren durchgeführt und hat über 2500 rezidivierte/refraktäre pädiatrische Krebspatienten aufgenommen, wobei etwa die Hälfte aller Fälle von unseren internationalen Partnern stammt. Die erste klinische Wirkungsanalyse zeigte einen Überlebensvorteil für Patienten mit sehr vorrangigen Zielen, die mit einem passenden Medikament behandelt wurden. Im Rahmen der Studie wurde eine personalisierte Ex-vivo-Plattform zur Erstellung von Profilen der Arzneimittelempfindlichkeit unter realen Bedingungen weiterentwickelt und erfolgreich implementiert, wodurch eine neue Ebene funktioneller Informationen für die klinische Entscheidungsfindung geschaffen wurde. Diese Routineanalyse befindet sich nun in der Übergangsphase zur Kostenerstattung durch die Krankenkassen in Deutschland und trägt dazu bei, solche Sequenzierungs- und Screening-Plattformen in anderen Ländern zu etablieren.
MNP Int-R ist eine Register-Folgestudie der vorangegangenen MNP 2.0-Studie, die das Prinzip der DNA-Methylierungssignaturen als Teil einer kombinierten histologischen und molekularen Tumorklassifikation untersuchte, um pädiatrische Hirntumoren zum Zeitpunkt der Primärdiagnose besser und genauer zu diagnostizieren. Dies ebnete den Weg, um die molekulare Diagnostik, einschließlich der Erstellung von DNA-Methylierungsprofilen und der gezielten Sequenzierung von Genpanels, in die Routinediagnostik von primären ZNS-Tumoren bei Kindern und Jugendlichen aufzunehmen und die Ergebnisse der Referenzpathologie, der Radiologie und der molekularen Diagnostik in eine mehrschichtige Tumordiagnose zu integrieren. MNP Int-R wird dem hohen diagnostischen Standard in einem internationalen Umfeld folgen und einen großen Einfluss auf das klinische Krankheitsmanagement haben. Gleichzeitig trägt die kontinuierliche Sammlung und Analyse von Daten dazu bei, noch unentdeckte Tumortypen und Subtypen zu identifizieren und die Biologie hinter sehr seltenen, molekular definierten Tumorklassen zu entdecken. Die Weiterentwicklung und das Training des auf DNA-Methylierung basierenden Klassifikationssystems helfen, die molekularen Parameter zu verbessern und das Design zukünftiger Therapiestudien langfristig zu gestalten, die die personalisierte Präzisionsbehandlung und neue zielgerichtete Therapieansätze beeinflussen.
Multiomic neuropathology improves diagnostic accuracy in pediatric neuro-oncology. Sturm D et al and Pietsch T*, Sahm F*, Pfister SM*, Jones DTW*. Nature Med. 2023. Accepted.
Amplification of the PLAG-family genes-PLAGL1 and PLAGL2-is a key feature of the novel tumor type CNS embryonal tumor with PLAGL amplification. Keck MK, Sill M, Wittmann A, Joshi P, Stichel D, Beck P, Okonechnikow K, Sievers P, Wefers AK, Roncaroli F, Avula S, McCabe MG, Hayden JT, Wesseling P, Øra I, Nistér M, Kranendonk MEG, Tops BBJ, Zapotocky M, Zamecnik J, Vasiljevic A, Fenouil T, Meyronet D, von Hoff K, Schüller U, Loiseau H, Figarella-Branger D, Kramm CM, Sturm D, Scheie D, Rauramaa T, Pesola J, Gojo J, Haberler C, Brandner S, Jacques T, Sexton Oates A, Saffery R, Koscielniak E, Baker SJ, Yip S, Snuderl M, Ud Din N, Samuel D, Schramm K, Blattner-Johnson M, Selt F, Ecker J, Milde T, von Deimling A, Korshunov A, Perry A, Pfister SM, Sahm F, Solomon DA, Jones DTW. Acta Neuropathol. 2022 Nov 27. doi: 10.1007/s00401-022-02516-2. Online ahead of print. PMID: 36437415
PATZ1 fusions define a novel molecularly distinct neuroepithelial tumor entity with a broad histological spectrum. Alhalabi KT, Stichel D, Sievers P, Peterziel H, Sommerkamp AC, Sturm D, Wittmann A, Sill M, Jäger N, Beck P, Pajtler KW, Snuderl M, Jour G, Delorenzo M, Martin AM, Levy A, Dalvi N, Hansford JR, Gottardo NG, Uro-Coste E, Maurage CA, Godfraind C, Vandenbos F, Pietsch T, Kramm C, Filippidou M, Kattamis A, Jones C, Øra I, Mikkelsen TS, Zapotocky M, Sumerauer D, Scheie D, McCabe M, Wesseling P, Tops BBJ, Kranendonk MEG, Karajannis MA, Bouvier N, Papaemmanuil E, Dohmen H, Acker T, von Hoff K, Schmid S, Miele E, Filipski K, Kitanovski L, Krskova L, Gojo J, Haberler C, Alvaro F, Ecker J, Selt F, Milde T, Witt O, Oehme I, Kool M, von Deimling A, Korshunov A, Pfister SM, Sahm F, Jones DTW. Acta Neuropathol. 2021 Nov;142(5):841-857. doi: 10.1007/s00401-021-02354-8. PMID: 34417833
Radiation-induced gliomas represent H3-/IDH-wild type pediatric gliomas with recurrent PDGFRA amplification and loss of CDKN2A/B. Deng MY, Sturm D, Pfaff E, Sill M, Stichel D, Balasubramanian GP, Tippelt S, Kramm C, Donson AM, Green AL, Jones C, Schittenhelm J, Ebinger M, Schuhmann MU, Jones BC, van Tilburg CM, Wittmann A, Golanov A, Ryzhova M, Ecker J, Milde T, Witt O, Sahm F, Reuss D, Sumerauer D, Zamecnik J, Korshunov A, von Deimling A, Pfister SM, Jones DTW. Nat Commun. 2021 Sep 20;12(1):5530. doi: 10.1038/s41467-021-25708-y. PMID: 34545083
The pediatric precision oncology INFORM registry: clinical outcome and benefit for patients with very high-evidence targets. van Tilburg CM et al. and Jones DTW, Molenaar JJ, Capper D, Pfister SM, Witt O. Cancer Discov. 2021 Aug 9:candisc.0094.2021. doi: 10.1158/2159-8290.CD-21-0094. Online ahead of print. PMID: 34373263
Infant high grade gliomas comprise multiple subgroups characterized by novel targetable gene fusions and favorable outcomes. Clarke M et al. and Ellison DW*, Jacques TS*, Jones DTW*, Jones C*.Cancer Discov. 2020 Apr 1. pii: CD-19-1030. doi: 10.1158/2159-8290.CD-19-1030. [Epub ahead of print]. PMID: 32238360
Molecular characteristics and therapeutic vulnerabilities across paediatric solid tumours. Jones DTW, Banito A, Grünewald TGP, Haber M, Jäger N, Kool M, Milde T, Molenaar JJ, Nabbi A, Pugh TJ, Schleiermacher G, Smith MA, Westermann F, Pfister SM.Nat Rev Cancer. 2019 Aug;19(8):420-438. doi: 10.1038/s41568-019-0169-x. Epub 2019 Jul 12. Review.PMID: 31300807
DNA methylation-based classification of central nervous system tumours. Capper D, Jones DTW, Sill M, Hovestadt V et al, and von Deimling A, Pfister SM. Nature. 2018 Mar 22;555(7697):469-474. doi: 10.1038/nature26000. Epub 2018 Mar 14. PMID: 29539639
- Anja Runge, PhD (Project Manager)
- Anna-Lisa Böttcher, PhD (Project Manager shared with Stefan Pfister)
- Andrea Wittmann (Technician)
- Kati Ernst (PhD Student shared with Marc Zuckermann)
- Jan Vaillant (PhD Student shared with Lena Kutscher)
- Laura von Soosten (PhD Student shared with Marc Zuckermann)
- Mirjam Blattner-Johnson, PhD (Postdoc)
- Michaela Keck, PhD (Postdoc)
- Kathrin Schramm, PhD (Postdoc)
- Barbara Jones, MD (Physician Scientist, Universitätsklinikum Heidelberg)
- Elke Pfaff, MD (Physician Scientist, Universitätsklinikum Heidelberg)
- Dominik Sturm, MD (Physician Scientist, Universitätsklinikum Heidelberg)
- Karam Al-Halabi (MD Student)
- Ashwyn Augustine Perera (MD Student)
- Devishi Kesar (PhD Student)
- Maria-Luisa Wiesinger (PhD Student)
- Nathalie Wilke (PhD Student)
- Jens Maile (Masterstudent)