Translationale Pädiatrische Radioonkologie
Die Nachwuchsarbeitsgruppe “Translationale Pädiatrische Radioonkologie” unter Leitung von Dr. Maximilian Deng ist ein Teil des KiTZ und dem Universitätsklinikum Heidelberg. Im Fokus der Arbeitsgruppe steht dabei die Anwendung von neuen molekularen Prädiktoren, die eine personalisierte, der Tumorbiologie-angepassten Auswahl der bestmöglichen Bestrahlungsart sowie Zielvolumendefinition ermöglicht. Zudem wird in enger Zusammenarbeit mit dem präklinischen Programm des KiTZ untersucht, welche Mutationen für eine Therapieresistenz gegenüber der Bestrahlung verantwortlich sind, um diese - im weiteren Schritt - mittels Kombinationstherapien therapeutisch anzugehen.
Das Ziel der Nachwuchsarbeitsgruppe ist es, innovative und personalisierte Behandlungskonzepte in der Bestrahlung von kindlichen Tumoren zu etablieren, um die Heilungsaussichten und das Nebenwirkungsprofil unserer jungen Patientinnen und Patienten langfristig zu verbessern.

Spotlight - JRG Deng
Molekulare Tumorcharakterisierung für eine personalisierte, der Tumorbiologie-angepassten Bestrahlungsplanung
Umfangreiche genomische Analysen haben unser biologisches Verständnis von der molekularen Vielfalt verschiedener kindlicher Krebsarten verbessert. Unsere Arbeit zielt darauf ab, die molekulare Heterogenität kindlicher Krebsarten als zusätzliches Stratum in die klinische Entscheidungsfindung bei der Behandlungsplanung miteinzubeziehen.
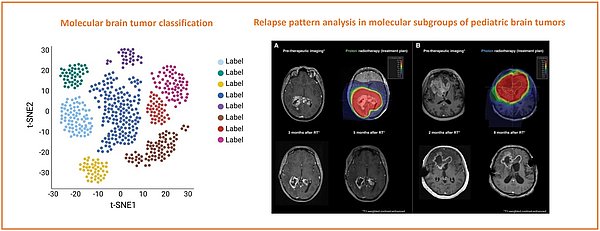
Kindliche Hirntumoren sind die führende Ursache krebsbedingter Todesfälle bei Kindern. Jüngste Fortschritte in der molekularen Charakterisierung haben unser Verständnis revolutioniert, insbesondere durch die Entdeckung molekularer Untergruppen innerhalb zuvor als homogen angesehener Tumorentitäten. Trotz signifikanter Fortschritte im Management bleibt das Tumorrezidiv eine Herausforderung. Die Rückfallmuster variieren erheblich zwischen den molekularen Untergruppen und spiegeln Unterschiede in Biologie und Therapieansprechen wider. Das Verständnis dieser Muster ist essenziell für die Therapieplanung in der Radioonkologie, wie etwa bei der Zielvolumendefinition. Durch umfassende genomische und klinische Daten wollen wir die Rezidivmuster nach Bestrahlung untersuchen. Unsere Erkenntnisse sollen das Wissen über das Wachstumsmuster kindlicher Hirntumoren erweitern und personalisierte Behandlungsansätze in der Bestrahlungsplanung zusätzlich voranbringen.
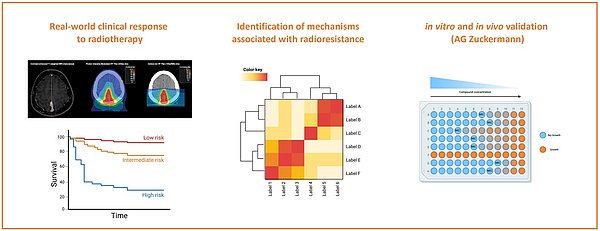
Die Strahlentherapie ist eine wesentliche Behandlungsmethode für verschiedene Krebserkrankungen, deren Wirksamkeit jedoch durch das Auftreten strahlenresistenter Tumorzellen eingeschränkt werden kann. Um dieser Herausforderung zu begegnen, möchten wir genetische und epigenetische Veränderungen identifizieren, die mit Strahlenresistenz assoziiert sind. Durch die retrospektive Analyse klinischer Daten und molekularer Profile behandelter Patienten zielen wir darauf ab, spezifische Veränderungen zu entdecken, die eine Resistenz gegen Strahlentherapie vermitteln. Diese Studie integriert umfassende genomische Daten mit Informationen aus dem klinischen Follow-up, um potenzielle Biomarker und therapeutische Ziele für personalisierte Behandlungsstrategien zu identifizieren. In Zusammenarbeit mit dem Präklinischen Programm am KiTZ (AG Zuckermann) werden in vivo-Modelle generiert, um diese mutmaßlichen Veränderungen zu testen und gezielt zu behandeln. Durch die Etablierung dieser Plattform sollen Kombinationstherapien zukünftig weiterentwickelt werden. Unsere Forschung soll das Verständnis der Mechanismen der Strahlenresistenz verbessern und mittels reverser Translation klinisch relevante genetische Veränderungen identifizieren - mit dem Ziel, das therapeutische Fenster zu erweitern und das Überleben der Patientinnen und Patienten zu verbessern.
Efficacy and toxicity of bimodal radiotherapy in WHO grade 2 meningiomas following subtotal resection with carbon ion boost: Prospective phase 2 MARCIE trial. Deng MY, Maas SLN, Hinz F, Karger CP, Sievers P, Eichkorn T, Meixner E, Hoegen-Sassmannshausen P, Hörner-Rieber J, Lischalk JW, Seidensaal K, Bernhardt D, Jungk C, Unterberg A, Wick A, Wick W, von Deimling A, Sahm F, Combs S, Herfarth K, Debus J, König L. Neuro Oncol. 2024 Apr 5;26(4):701-712. doi: 10.1093/neuonc/noad244. PMID: 38079455; PMCID: PMC10995516.
Analysis of recurrence probability following radiotherapy in patients with CNS WHO grade 2 meningioma using integrated molecular-morphologic classification. Deng MY, Hinz F, Maas SLN, Anil G, Sievers P, Conde-Lopez C, Lischalk J, Rauh S, Eichkorn T, Regnery S, Bauer L, Held T, Meixner E, Lang K, Hörner-Rieber J, Herfarth K, Jones D, Pfister SM, Jungk C, Unterberg A, Wick W, von Deimling A, Debus J, Sahm F, König L. Neurooncol Adv. 2023 May 14;5(1):vdad059. doi: 10.1093/noajnl/vdad059. PMID: 37293256; PMCID: PMC10246580.
Radiation-induced gliomas represent H3-/IDH-wild type pediatric gliomas with recurrent PDGFRA amplification and loss of CDKN2A/B. Deng MY, Sturm D, Pfaff E, Sill M, Stichel D, Balasubramanian GP, Tippelt S, Kramm C, Donson AM, Green AL, Jones C, Schittenhelm J, Ebinger M, Schuhmann MU, Jones BC, van Tilburg CM, Wittmann A, Golanov A, Ryzhova M, Ecker J, Milde T, Witt O, Sahm F, Reuss D, Sumerauer D, Zamecnik J, Korshunov A, von Deimling A, Pfister SM, Jones DTW. Nat Commun. 2021 Sep 20;12(1):5530. doi: 10.1038/s41467-021-25708-y. PMID: 34545083; PMCID: PMC8452680.
Diffuse glioneuronal tumour with oligodendroglioma-like features and nuclear clusters (DGONC) - a molecularly defined glioneuronal CNS tumour class displaying recurrent monosomy 14. Deng MY, Sill M, Sturm D, Stichel D, Witt H, Ecker J, Wittmann A, Schittenhelm J, Ebinger M, Schuhmann MU, Figarella-Branger D, Aronica E, Staszewski O, Preusser M, Haberler C, Lauten M, Schüller U, Hartmann C, Snuderl M, Dunham C, Jabado N, Wesseling P, Deckert M, Keyvani K, Gottardo N, Giangaspero F, von Hoff K, Ellison DW, Pietsch T, Herold-Mende C, Milde T, Witt O, Kool M, Korshunov A, Wick W, von Deimling A, Pfister SM, Jones DTW, Sahm F. Neuropathol Appl Neurobiol. 2020 Aug;46(5):422-430. doi: 10.1111/nan.12590. Epub 2020 Feb 5. PMID: 31867747.
Molecularly defined diffuse leptomeningeal glioneuronal tumor (DLGNT) comprises two subgroups with distinct clinical and genetic features. Deng MY, Sill M, Chiang J, Schittenhelm J, Ebinger M, Schuhmann MU, Monoranu CM, Milde T, Wittmann A, Hartmann C, Sommer C, Paulus W, Gärtner J, Brück W, Rüdiger T, Leipold A, Jaunmuktane Z, Brandner S, Giangaspero F, Nozza P, Mora J, Morales la Madrid A, Cruz Martinez O, Hansford JR, Pietsch T, Tietze A, Hernáiz-Driever P, Stoler I, Capper D, Korshunov A, Ellison DW, von Deimling A, Pfister SM, Sahm F, Jones DTW. Acta Neuropathol. 2018 Aug;136(2):239-253. doi: 10.1007/s00401-018-1865-4. Epub 2018 May 15. PMID: 29766299.